近日
国家药品监督管理局
发布督抽检结果显示
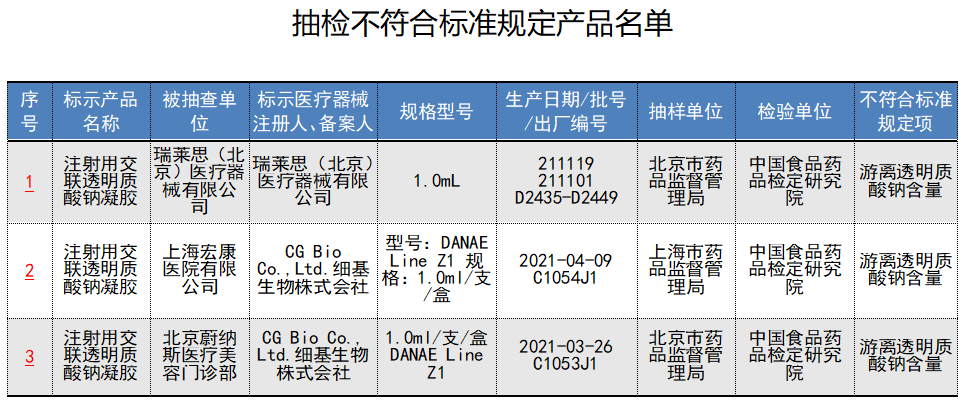
3批次
注射用透明质酸钠凝胶不合格
不合格项目均为
游离透明质酸钠含量
其中,1批次由瑞莱思(北京)医疗器械有限公司生产;2批次C1054J1、C1053J1为CG Bio Co.,Ltd.细基生物株式会社生产的婕尔DANAE Line。
▲3批次注射用玻尿酸不符合规定。透明质酸钠即为俗称的玻尿酸。
对上述不符合标准规定产品,国家药品监督管理局已要求医疗器械注册人所在地省级药品监督管理部门按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》《医疗器械召回管理办法》等要求,及时作出行政处理决定并向社会公布。
DANAE Line同批次产品
去年曾因不合格被召回
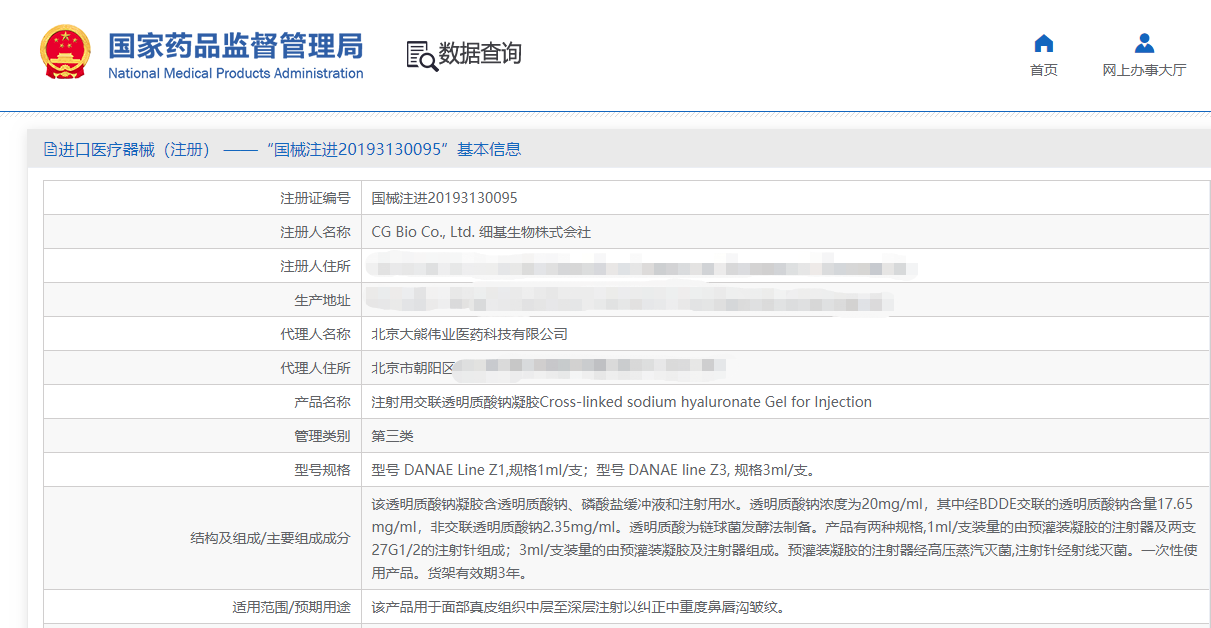
记者了解到,CG Bio Co.,Ltd.细基生物株式会社为韩国大熊制药株式会社(DAEWOONG)旗下公司,其旗下玻尿酸品牌为婕尔GISELLELIGNE,共计有3种型号,分别为:DANAE Original、DANAE Line、DANAE Contour,其中,不含利多卡因的DANAE Line于2019年3月获批上市。
经国家药监局网站查询得知,DANAE Line为进口产品,注册编证号为国械注进20193130095,国内代理人为北京大熊伟业医药科技有限公司。
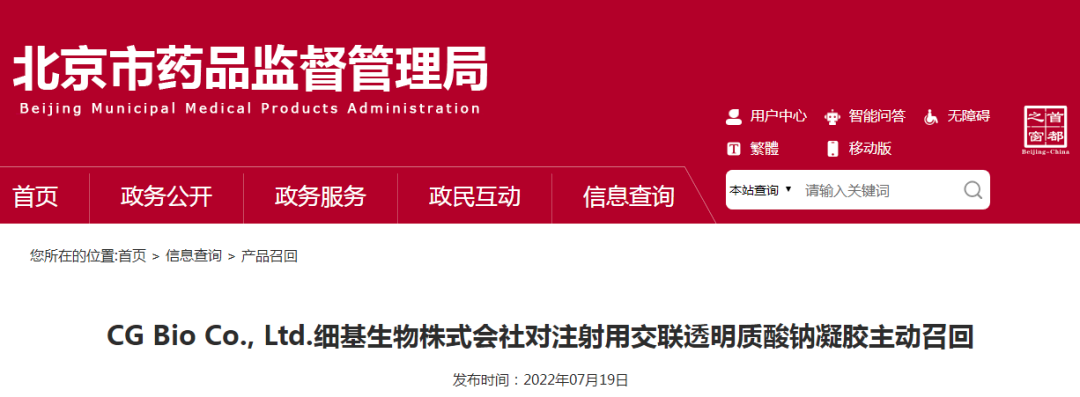
而记者了解到,2022年7月,北京大熊伟业医药科技有限公司报告,CG Bio Co., Ltd.细基生物株式会社对和此次抽检公布显示相同的C1053J1、C1054J1批次DANAE LineZ1注射用交联透明质酸钠凝胶进行召回。
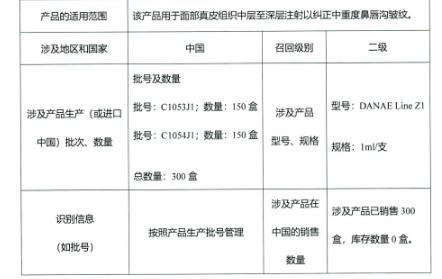
召回原因为经2022年国家医疗器械抽查检验,游离透明质酸钠含量不符合《产品技术要求》中的性能指标要求。《产品技术要求》中规定游离透明质酸钠的范围值为标识含量的90%-120%,而2022年召回的两批次C1053J1、C1054J1产品分别为151%,149%。
那么,此次抽检不合格与去年召回时所称的抽检情况是否是同一事件?
《中国消费者报》记者联系到北京大熊伟业医药科技有关工作人员,对方表示了解情况后将进行反馈。截至发稿,记者未收到回复。
瑞莱思因产品抽检不合格
被处罚款746700元
此外,瑞莱思生产的批号为211101的一批次注射用透明质酸钠凝胶也因游离透明质酸钠含量项目不合格。
1月5日,记者在信用中国网站查询发现,北京市市场监管局2022年12月开具的行政处罚书显示:
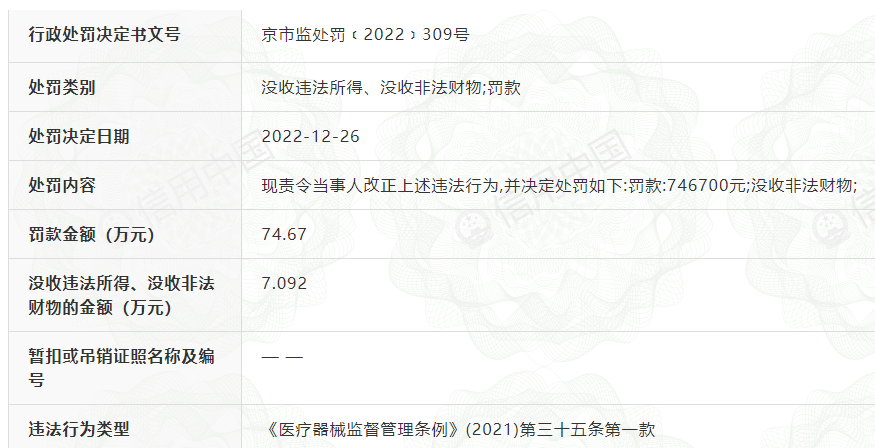
瑞莱思2021年11月16日开始生产注射用交联透明质酸钠凝胶(批号:211101),2022年1月11日完成生产,共计生产2489支,质量留样80支。2022年3月21日,北京市药品监督管理局抽检15支产品,经中国食品药品检定研究院检验(检验报告编号:QC202204102),游离透明质酸钠含量项目检验结果为3.5mg/mL,经注册的产品技术要求规定为2.3±0.3,不符合经注册的产品技术要求的规定。2022年6月23日,当事人申请复检。
2022年9月30日,市场监管部门收到北京市医疗器械检验研究院检验报告(报告编号:F-G-0004-2022),游离透明质酸钠含量项目检验结果为3.1mg/mL,不符合经注册的产品技术要求。2022年6月21日当事人自检使用10支(来自质量留样),目前库存2464支。
处罚决定书显示,该产品没有销售。按照当事人提供的相同产品其他批号销售单价30.00元/支计算,该批产品货值金额为74670元。市场监管部门责令当事人改正上述违法行为,并处罚款746700元。
中国消费者报新媒体编辑部出品
记者/孟刚
编辑/裴莹
监制/何永鹏 任震宇





发表评论:
◎欢迎参与讨论,请在这里发表您的看法、交流您的观点。